Fehlerhafte Qualitätskontrolle im Gehirn
Neuer Maustyp macht sichtbar, wenn Nervenzellen fehlgefaltete Proteine nicht ausmustern
Proteine sind die "Werkzeuge" unserer Zellen – sie führen alle lebenswichtige Aufgaben aus. Das können sie jedoch nur, wenn sie sich richtig falten und ihre jeweilige, ganz spezielle 3D-Struktur einnehmen. Damit dabei nichts schiefgeht, wird dieser Vorgang in der Zelle streng überwacht. Die Auswirkung einer fehlerhaften Qualitätskontrolle zeigt sich zum Beispiel in der Ablagerung falsch gefalteter Proteine bei neurodegenerativen Erkrankungen wie Alzheimer. Forschende an den Max-Planck-Instituten für Neurobiologie und für Biochemie haben nun einen Maustyp entwickelt, der den Zustand des Proteinhaushalts erstmals im Gehirn von Säugetieren sichtbar macht. So lassen sich die Prozesse der Protein-Qualitätskontrolle in gesunden und kranken Nervenzellen genauer untersuchen.
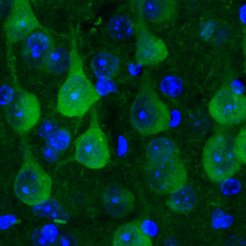
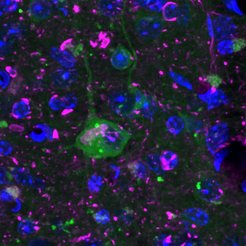
Proteine erfüllen in unserem Körper alle wichtigen Aufgaben: Sie transportieren Stoffe, schützen vor Krankheiten, stützen die Zelle und katalysieren chemische Reaktionen – um nur einige davon zu nennen. Mit der Bauanleitung in unserem Erbgut kann jedes Protein als eine Kette aneinandergereihter Aminosäuren hergestellt werden. Damit ist es aber lange noch nicht getan: Denn um ihren lebenswichtigen Funktionen nachzugehen, müssen sich Proteine zu komplexen 3D-Strukturen falten.
In der Zelle gibt es eine ganze Maschinerie, die Proteinen beim Falten hilft, fehlgefaltete Proteine korrigiert oder beseitigt. Als Art Qualitätskontrolle trägt das System damit zur Proteostase bei – der kontrollierten Funktion aller Proteine.
In gesunden Zellen funktioniert diese Qualitätskontrolle sehr gut. Im Alter hingegen lässt sie allmählich nach. Dies kann vor allem für Nervenzellen zum Problem werden. Diese Zellen erneuern sich nicht und sind somit ein Leben lang auf eine stabile Proteinfunktion angewiesen. Tatsächlich ist neurodegenerativen Erkrankungen wie Alzheimer, Parkinson oder Chorea Huntington gemein, dass bestimmte, fehlgefaltete Proteine das Qualitätskontrollsystem überlasten und nicht entsorgt werden. Die Proteine reichern sich an, verklumpen und lagern sich schließlich ab. Je nach Erkrankung kann dies zur Beeinträchtigung des Gedächtnisses oder der Muskelkontrolle führen – bisher ohne Heilungschancen. Ein Verstärken der zellulären Qualitätskontrolle in Nervenzellen könnte daher eine vielversprechende Therapiemöglichkeit darstellen.
Um die Störungen in den einzelnen Krankheiten im Detail besser untersuchen zu können, entwickelten Wissenschafter:innen um Irina Dudanova eine neue Mauslinie. Mit dieser lässt sich der Proteostase-Zustand zum ersten Mal in Säugetier-Nervenzellen sichtbar machen.
Dazu schleusten die Forschenden das Protein, welches normalerweise Leuchtkäfer zum Leuchten bringt, in die Nervenzellen der Maus ein. Optimiert auf die Körpertemperatur des Käfers, benötigt das Protein in "wärmeren" Säugetieren unentwegt Hilfe beim Falten. Nur dann kann es seine korrekte Struktur einnehmen und Licht produzieren. Um dem Ort des Leucht-Proteins in der Zelle genau aufzuspüren, markierten die Wissenschaftler:innen es zusätzlich mit einem Farbstoff. So zeigten sie, dass sich das Protein in gesunden Nervenzellen gleichmäßig verteilt und leuchtet. Ist die Protein-Qualitätskontrolle aber überfordert, verklumpt das Käferprotein und leuchtet nicht mehr so stark. Somit dient das Leuchtprotein als Proteostase-Sensor.
Die neu entwickelte Mauslinie kreuzten die Forschenden anschließend mit Mäusen, die unterschiedliche neurodegenerativen Erkrankungen nachbilden. In Mäusen, welche Anzeichen der Alzheimer-Krankheit aufweisen, verklumpte das Leuchtprotein und signalisierte eine starke Proteostase-Störung. Interessanterweise war dies in Chorea-Huntington-Mäusen nicht der Fall. Irina Dudanova erzählt: „Die unterschiedlichen Ergebnisse waren sehr überraschend. Beim genaueren Untersuchen der Ursache stellten wir fest, dass sowohl die fehlgefalteten Proteine selbst, als auch deren Ort in der Zelle eine wichtige Rolle spielen.“
Während das fehlgefaltete Protein im Alzheimer-Modell nämlich im Zellkörper Ablagerungen bildet, verklumpt es im Huntington-Mausmodell im Zellkern. Die Protein-Qualitätskontrolle und deren Kapazität kann innerhalb einer Zelle demnach stark schwanken. „Das zeigt, wie komplex die Qualitätskontrolle von Proteinen ist und wie unterschiedlich die Störungen in einzelnen neurodegenerativen Krankheiten verlaufen können“, erklärt Irina Dudanova.
Mit der neuen Mauslinie haben Wissenschaftler:innen nun ein Werkzeug an der Hand, um dieser Komplexität gezielt nachzugehen – sowohl in gesunden als auch in kranken Nervenzellen. Irina Dudanova möchte mit ihrem Team noch weitere neurodegenerative Krankheiten untersuchen und herausfinden, ob verschiedene Zelltypen im Gehirn unterschiedlich schnell betroffen sind. Zudem ist es denkbar, dass der neue Maustyp helfen kann, die Wirksamkeit verschiedener Therapieformen für neurodegenerative Erkrankungen zu beurteilen.
Audioversion
Keine Zeit zum Lesen?
Hören Sie sich diese Forschungsnachricht doch einfach an!













